Exames realizados em sangue com anticoagulante:
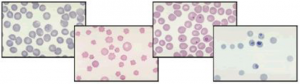
Amostras com anticoagulantes são indicadas para hemograma completo (contagem global de hemácias, leucócitos, plaquetas, determinação do hematócrito, VCM; HCM; CHCM, e dosagem de hemoglobina), dosagem de pH e de metabólitos sangüíneos (glicose, ácido láctico, amônia), presença quantitativa de algum metal (chumbo, zinco, manganês, molibdênio e cádmio), pesquisa de células LE, dosagem de hemoglobina glicosilada para controle do diabetes, etc.
Tipos de anticoagulantes
Dependendo do tipo do exame que se deseja realizar é necessário que o sangue seja acondicionado em tubos com diferentes anticoagulantes.
EDTA (tampa Roxa)
Comercializado em forma de sal di-potássio, di-sódico e tri-potássico sendo os dois últimos os mais utilizados. É o anticoagulante de eleição para hematologia. A coagulação se evita pela eliminação do cálcio do sangue. Podem ser feitas contagens de 24 a 36 horas após a coleta, se a amostra estiver mantida em uma temperatura de refrigeração de 4º C. Nunca deve ser congelado e nem sofrer temperaturas superiores a 37º C, nestes casos a amostra é totalmente inviável.
Um tempo excessivo da amostra com anticoagulante leva a vacuolização dos monócitos, seguido do inchamento dos linfócitos, presença de vacúolos nos neutrófilos podendo ser facilmente confundidos com inclusões tóxicas. Pode ocorrer ainda a destruição das hemácias
HEPARINA (Tampa Verde)
É um anticoagulante natural. É usada uma concentração de 0,2 ml de heparina saturada por cada ml de sangue. É o anticoagulante de eleição para a dosagem de chumbo.
CITRATO (tampa azul)
É o anticoagulante ideal para estudos de coagulação. Utiliza-se a concentração de uma parte de citrato de sódio para 9 partes de sangue total. É imprescindível manter a relação anticoagulante/sangue para realizar as provas de coagulação. Os valores obtidos sem esta relação não têm nenhum valor diagnóstico. Este anticoagulante atua quebrando o cálcio, formando um complexo com o mesmo e impedindo o processo de coagulação.
FLUORETO (tampa preta)
Recomendado especificamente para a dosagem de glicose, pois inibe o processo de glicólise, que ocorre nas hemácias, mantendo os níveis in vitro deste metabólito por mais tempo. A dosagem deverá ser feita em até 6 horas após a coleta, pois o processo de glicólise continua, mesmo com a presença de fluoreto de sódio que apenas retarda este processo.
Atenção
– Deve-se sempre conservar a proporção entre o sangue e o anticoagulante, pois o excesso ou a falta de anticoagulante leva a resultados alterados.
– O sangue a ser transferido para o tubo com anticoagulante nunca deverá conter coágulos.
Não deve ser utilizado material reciclado. Os produtos utilizados para limpeza podem levar a uma destruição generalizada das hemácias e degeneração de todas as formas sanguíneas. Todas as amostras obtidas sob estas condições deveriam ser descartadas já que se perde confiabilidade diagnóstica, tempo e dinheiro.